8割の企業で臨床開発に影響~新型コロナの各社影響と対応
■製薬24社の本紙調査から
新型コロナウイルスの感染拡大は製薬企業の臨床開発にも大きな影響を与えた。緊急事態宣言発令後の4月に本紙が製薬24社を対象に実施したアンケート調査では、20社が「影響が出ている」「影響が出る可能性がある」と回答し、進行しているプロジェクトでの新規患者登録の一時中断や新規治験を当面自粛するなど対応を行っていたことが分かった。医療機関への訪問が制限され、臨床開発業務への負荷増大やデータ品質管理、治験実施施設の確保がより困難になるなど課題も浮き彫りになった。
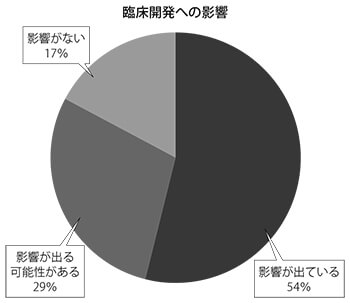
本紙は、緊急事態宣言発令後に製薬企業に対し臨床開発への影響を聞いた。緊急事態宣言後にプロジェクトの遅延・中断、新規治験中止など臨床開発で影響が出ているかを聞いたところ、「影響が出ている」が13社、「影響が出る可能性がある」が7社、「影響がない」が4社となった。
緊急事態宣言発令前に実施したアンケート調査では医薬品の研究開発に「影響あり」としたのは約3分の1に過ぎなかったが、緊急事態宣言発令後には約8割が新型コロナウイルス感染症に対する影響を認めていた。
臨床開発での影響については「新規被験者登録の中断」「プロジェクト、症例登録の遅延」「新たな医療機関との契約、治験開始の準備や新規患者の組み入れは当面中止」が多く挙がった。ある外資系企業では、生命に重大な影響があり、他の治療選択肢が限定されている疾患を対象とした一部の治験を除き、国際共同治験での被験者組み入れを見送る判断を行っていた。
製薬企業担当者の訪問や医師面会を制限する医療機関が増加し、新型コロナウイルス感染症疑いのある被験者の規定来院を医療機関が拒否するという事例もあったという。施設で実施される治験審査委員会(IRB)の延期も示され、医療機関から被験者宅への治験薬配送の要請も行われていた。SMOに所属する治験コーディネーターの治験実施医療機関への入場制限を行う施設もあった。
さらに治験薬配送では航空便の減便により、配送依頼時期や検体回収時間の前倒しが必要となり、地域によっては通常よりも日数を要する状況となった。海外医療機関については臨床検査サンプル輸送の遅延リスクを想定し、一部のサンプルについて輸送条件の変更を決定した企業もあった。
一部の医療機関で治験の受け入れを中断、中止したことに伴い、医療機関を変更せざるを得なくなり、治験が当初予定より遅延したほか、医療機関や当局とのコミュニケーションにも支障を来したため、「治験に関するデータ入手の遅延」「施設や当局とのやり取りの遅延」なども発生した。
被験者側でも、医療機関閉鎖や来院による感染リスクを恐れ、来院拒否により規定されたスケジュール取りに治験薬投与(注射剤)ができなくなったケースが見られた。同意取得後に治験参加を取りやめる被験者や、被験者を登録できる状況にあるものの被験者登録を延期する施設もあったようだ。
さらに、「治験実施施設へのモニタリング担当者の訪問規制」「訪問規制によるデータの直接閲覧の延期や未実施」「患者の来院時期変更とこれに伴う検査や評価時期のズレ」「実施手順の見直しに伴う同意説明文書、治験実施計画書、各種手順書などの改訂」「医療機関から新規の被験者スクリーニングの中断連絡」も報告された。
アンケートの回答時点では影響が出ていないものの、新型コロナウイルス感染拡大が長期化することによる影響を危惧する声もあった。さらに在宅勤務下で、「紙媒体での手続きを引き続き求める医療機関」に対応が難しい」との回答もあった。
海外で実施している臨床試験については、「新規被験者登録の中断」「施設・当局とのやりとりの遅延」といった影響に加え、国境閉鎖などで被験者が被験者が来院できていない症例もあり、問題が長期化する場合に治験薬投与(注射剤)ができなくなり、プロトコルの逸脱も起こった。
■新規登録の一時中断多く
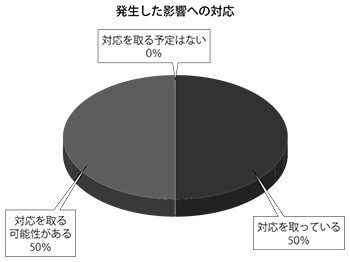
臨床試験での影響について今後の対応予定を聞いたところ、回答企業20社のうち、「対応を取っている」が10社、「対応を取る可能性がある」が10社と、全ての企業が「対応する」と回答した。
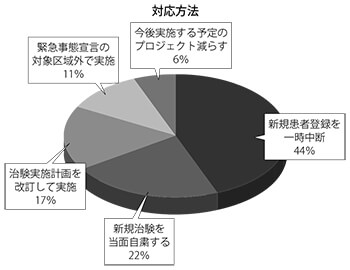
具体的な対応方法を複数回答で尋ねたところ、「進行しているプロジェクトで新規患者登録を一時中断する」が8社、「新規治験は当面自粛する」が4社、「治験実施計画を改訂して実施する」が3社、「緊急事態宣言の対象区域外で実施医療機関を選定して治験を実施する」が2社、「今後実施する予定のプロジェクトを減らす」が1社となった。
具体的には治験薬の患者宅配送での対応が多く挙がった。ある企業では医薬品医療機器総合機構(PMDA)からの伝達を踏まえ、実施を継続している治験については、「患者の通院が困難になった場合に備え、治験薬の医療機関から患者宅への配送が対応できるよう準備している」と説明した。そのほか、医師主導臨床研究については緊急事態宣言解除後にスケジュールなどの再調整を行う必要性も指摘された。
臨床試験、被験者や医療機関への影響を検討し、適切な対応方法を決定する企業もある。内資系企業では実施中の試験についてリスク対応表を作成し、リスク評価を行っていた。国内試験ではPMDAから発出された「新型コロナウイルス感染症の影響下での医薬品、医療機器及び再生医療等製品の治験実施に係るQ&Aについて」をもとに、試験内容に準じた対応を検討・実施し、個別に判断していた。
外資系企業でも「治験責任医師が各臨床試験で定められた安全性と有効性の観察を実施できると判断した場合に限り、進行中の臨床試験に新規の患者登録を行い、治療領域や対象疾患を考慮し、例外的に個別試験の登録中止を検討する」とした。そのほか、医療機関外からのリモートアクセスの強化や既存プロセスからの代替手段の準備を行うとの回答もあった。
■9社が業務負荷の増大懸念
今後の臨床開発に対する影響として懸念されるものを複数回答で聞いた。上位回答では「臨床開発業務の負荷が増大する」が9社、「製薬企業から実施医療機関へのフォローが不足し、データ品質管理に問題が生じる」が8社、「治験実施施設の確保がより困難になる」が8社となった。
次いで「新型コロナウイルス感染症治療薬、ワクチン開発が優先され、他領域での開発が停滞する」が4社、「研究開発費(臨床開発コスト)の大幅な増加など開発リスクが増大する」が4社、「被験者側で治験参加への抵抗感がより一層進む」が4社、「国内治験の空洞化がより進む」が1社、「不安がない」が1社となった。
感染拡大に伴い被験者の継続的な安全確保や投与の継続が実現できる体制に対する不安や治験実施期間の延長、治験進捗の遅れなどを懸念する意見も多かった。「現在の状況が改善した際には臨床開発業務の負荷が増大し、各社一斉に再開することから治験実施施設の確保がより一層難しくなる」と新型コロナの収束後についても懸念が示されていた。
今後への影響で「被験者側で治験参加への抵抗感がより一層進む」と回答した企業では、「疾患領域によって被験者側の治験参加への抵抗感が大きく異なり、短期的には生活習慣病や健常人を対象としたワクチンなどの試験で、医療機関に行くことへの抵抗感が大きくなる可能性がある」とコメントした。
日本での将来的な臨床開発のあり方について聞いたところ、新規治験や治験継続の判断については、患者の安全性確保を優先して臨床開発を行うべきとの意見が相次いだ。
主な意見としては、「感染拡大の懸念がある中では臨床開発を継続していくことが難しく、まずは早期に流行が沈静化するよう、政府、行政、業界団体が示す取り組みを行っていく」「国内の臨床開発では新型コロナウイルス感染症の流行拡大の抑止を第一に考え、臨床試験の実施については延期・中止を含め慎重に検討する必要がある」と慎重論が多かった。
一方、「現場の医療機関では多大な負担が生じているため、新規に治験を実施する場合はその点を踏まえて検討する必要がある。ただ、被験者の感染リスク回避を第一に考慮した上で、治験に登録されている被験者は可能な限り最後まで実施してもらいたい」との声も挙がった。製薬企業としても治験を実施する上で限られた医療資源の利用を最適化できるよう、「開発ポートフォリオの優先順位を判断することが重要」と開発戦略の見直しも求められるとした。
治験プロセスについてはやむを得ず、平常時と異なる手順で実施した工程は、「経緯と妥当性に関する記録を詳細に残す」「実施計画書などの重大な変更は必要に応じてPMDAと緊密に連携すべき」と手順に基づいた治験実施を徹底していく必要性が指摘された。
治験を実施するためには医療機関との関係構築も重要な課題となっている。オンライン診療の普及と共に医療機関関係者や被験者の負担軽減を図り、「パンデミックなどの非常事態時を想定した実施医療機関との連携体制を事前に整備しておくべき」と準備体制についての指摘もあった。
治験業務の負荷軽減のために治験の電子化・自動化への要望も多かった。新型コロナウイルス感染症拡大を契機に「電子カルテとの互換性を向上したEDCシステムの普及」や「治験届やIRB申請、承認申請の電子化」「モニタリング・SDV業務のリモート化」「日本医療研究開発機構(AMED)支援による強化のもと医師主導治験の拡充」など各社が提案していた。
治験データ収集の自動化や医療機関でのモニタリングを代替するリモートモニタリング、リスクに基づくモニタリング、治験薬直送は治験の効率化に向けた対応策の一つとなりそうだ。医療機関外でのバーチャル試験を推進する外資系企業は、「従来の医療機関への定期的な来院を基本とした臨床試験から、デジタル技術や治験薬の配送などを活用し、一部の来院をオンライン診療や訪問医療、自宅などで対応できる柔軟性のある治験が必要」と指摘した。
治験業務では医療機関やその他の施設に訪問しなければ実施できない業務も多いことから、「リモートで業務を完結できるような仕組みづくりを行う必要があり、治験での事務手続きを含め、紙の書類をなくすペーパーレスやリモート化をより一層推進すべき。この機会に不要不急の作業を減らすことで今後の臨床試験のスピードアップと効率化を図ることができる」と意義を強調する。
国際共同治験の増加を背景に国際標準での治験プロセスが求められる中、ある企業は治験の電子化・自動化を実現するために、「緊急事態下でスピード感を持って国を超えた共通のプロセスで対策を講じるべき」と言及した。医療機関訪問による治験業務が多いが「新型コロナウイルス感染症の流行が収束した後も導入した手順で生かせるものは当局、業界、医療機関の理解のもとで生かしていくべきだと考える」とし、緊急避難的な対応ではなく治験の標準プロセスに活用する方向性も検討課題になりそうだ。
実際、対面での会合が必須だった治験説明会がウェブ経由でも受け入れられるケースが出てきており、「治験手続きなどの電子化を広く普及させ、テレワークで対応できる業務範囲を広げるべき」との意見も出た。
施設や社内の手続きでは紙の書類が多く使われ、押印が必要な場合があるが、「全ての面においてペーパーレスで手続きが完了する体制整備が必要」との要望も見られた。
■国際共同治験参加の要請も
新型コロナウイルス感染症ワクチン・治療薬の臨床開発に向けても、産官学連携など協力関係を構築し、日本が治療薬・ワクチンの国際共同治験に参加する枠組みを要請している。「製薬企業間のデータや技術、専門性、製造能力などの共有や産官学の連携が必要であり、世界各国が協力して研究を行い、国際共同治験で得た有効性・安全性データを相互に利用し、ワクチンや治療薬が各国で早く使用する体制が必要」との回答も出ており、日本でも速やかに国際共同治験の実施や外国人データを含む承認申請が受け入れられる体制を要望した。
新型コロナウイルス感染症の影響を踏まえ、PMDAから「新型コロナウイルス感染症の影響下での医薬品、医療機器及び再生医療等製品の治験実施に係るQ&Aについて」が発出された。ただ、内資系中堅からは「諸外国の通知内容と比較して非常に内容が乏しいものである。製薬企業間で情報・対応案を収集し、会社単位ではなく製薬業界として被験者保護のためのより具体的な方策を議論し、業界として方針を定める必要があるのではないか」との厳しい指摘も出ていた。
<この記事を読んだ方におすすめ>
20代で転職する薬剤師の転職ノウハウ|対策・転職理由・注意点
出典:薬事日報












薬+読 編集部からのコメント
薬事日報社が製薬24社を対象に実施したアンケート調査によりますと、新型コロナウイルスの感染拡大によって、20社が「影響が出ている」「影響が出る可能性がある」と回答し、進行中プロジェクトでの新規患者登録の一時中断や、新規治験の当面自粛など、製薬企業の「肝」ともいえる臨床開発に多大な影響が出ていることが判明しました。また医療機関への訪問が制限されているため、臨床開発業務への負荷増大やデータ品質管理、治験実施施設の確保がより困難になるなど課題も浮き彫りになっています。