AGは初後発で2成分登場
厚生労働省は15日、後発品308品目を薬価基準に収載する。初の後発品収載は、高血圧治療用配合剤「イルベサルタン・アムロジピンベシル酸塩」(アイミクス=大日本住友製薬)など15成分119品目。新規収載希望が10品目を超えた内用薬を先発品の「0.4がけ」とするルールは、「イルベサルタン・アムロジピンベシル酸塩」の1成分のみに適用され、多くの企業が参入する大型製品が少なかった。また、先発品メーカーから特許使用の許可を得て後発品として発売するオーソライズドジェネリック(AG)は、初後発に限ると「イルベサルタン・アムロジピンベシル酸塩」と「レボフロキサシン水和物」の2成分4品目が収載される。
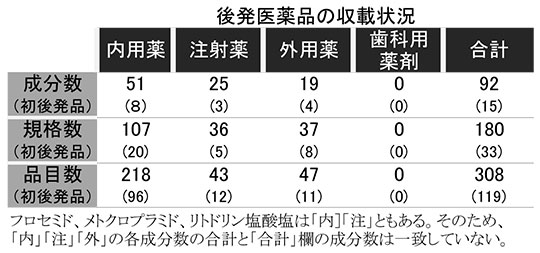
今回、薬価収載の希望品目は340品目だったが、局方名収載などによって7品目が告示不要となり、安定供給上の不安や採算上の理由、企業の都合によって25品目が取り下げられたことから、最終的に65社の92成分180規格308品目が収載される。
収載状況の内訳を見ると、内用薬が51成分107規格218品目、注射薬が25成分36規格43品目、外用薬が19成分37規格47品目となった。歯科用薬剤はなかった。
初めて収載された後発品は、高血圧治療薬のイルベサルタン・アムロジピンベシル酸塩、高リン血症治療薬の炭酸ランタン水和物、骨粗鬆症治療薬のミノドロン酸水和物、抗てんかん薬のラモトリギン、そう痒症改善薬のナルフラフィン塩酸塩、抗不整脈薬のフレカイニド酢酸塩、抗インフルエンザウイルス薬のオセルタミビルリン酸塩など15成分33規格119品目。内用薬が8成分20規格96品目、注射薬が3成分5規格12品目、外用薬が4成分8規格11品目となった。
そのうち、先発品メーカーから特許使用の許可を得て後発品として先行発売するオーソライズドジェネリック(AG)は2成分4規格4品目が収載される。イルベサルタン・アムロジピンベシル酸塩に対し、DSファーマバイオメディカルが「イルアミクス配合錠LD『DSPB』」と「同HD」の2規格2品目を発売。レボフロキサシン水和物に対し、第一三共エスファが「レボフロキサシン点滴静注バッグ500mg/100mL『DSEP』」と「同点滴静注500mg/20mL『DSEP』」の2規格2品目を発売する。
医療安全の観点から一般名に名称変更したなどの代替新規を含め、収載品目数が多かった企業は、東和薬品が24品目と最も多く、次いであすか製薬の21品目、沢井製薬の17品目、日医工の16品目、武田テバの15品目となった。
代替新規を除いた収載品目数の上位5社は、東和薬品の22品目、次いで沢井製薬の17品目、日医工の14品目、日本ジェネリックの9品目、大原薬品の8品目となった。
後発品の収載品目数が最も多かったのは、イルベサルタン・アムロジピンベシル酸塩の15社30品目、次いでベポタスチンベシル酸塩の7社22品目、ミノドロン酸水和物の9社18品目、ラモトリギンの5社16品目、炭酸ランタン水和物の6社14品目、ナルフラフィン塩酸塩の10社11品目となった。
新規収載希望が10品目を超えた内用薬を先発品の「0.4がけ」とするルールは、イルベサルタン・アムロジピンベシル酸塩の1成分30品目のみに適用される。












薬+読 編集部からのコメント
厚生労働省が本日、ジェネリック医薬品308品目を薬価基準に収載します。
主な後発品としては、「イルベサルタン・アムロジピンベシル酸塩」で、新規収載希望が10品目を超えた内用薬を先発品の「0.4がけ」とするルールが適用される見込みです。初後発のオーソライズドジェネリックは「イルベサルタン・アムロジピンベシル酸塩」と「レボフロキサシン水和物」の2成分4品目が収載されます。